
Dispositifs médicaux : classification et réglementation
-
01 mai 2017
-
Par : Mostafa EL HALI
-
Tags :
L'objectif principal de cet article est d'aider les professionnels de la santé, en particulier les pharmaciens d’officine, à bien maîtriser les dispositifs médicaux (DM) en termes techniques, scientifiques et législatifs afin de bien les utiliser, les conseiller ou les vendre.
Nous allons traiter l’exclusivité réservée au pharmacien d’officine en termes législatifs, la définition, la classification, la réglementation et les caractéristiques des Dispositifs Médicaux dans le Dahir n° 1-13-90, ainsi les mesures réglementaires du Décret n° 2.14.607 d'application de cette loi.
1- Introduction
A- Historique
Le secteur des dispositifs médicaux joue un rôle crucial dans le diagnostic, la prévention, le contrôle et le traitement des maladies, ainsi que dans l'amélioration de la qualité de vie des personnes souffrant de handicaps.
Les D.M représentent un business qui rapporte gros et que certains ont toujours su exploiter à outrance depuis des décennies mettant à profit le vide juridique qui caractérise le matériel médical importé par les différentes sociétés et intermédiaires , et depuis très longtemps, le matériel médical importé par les différentes sociétés, qu'il soit neuf, mais surtout d'occasion, n'a jamais fait l'objet de contrôle digne de ce nom:
1-Avant 1997 : Anarchie de commercialisation des DM
2-1997 : La circulaire N°7 du 19 Février 1997 relative à l’enregistrement des DM
3-Après 19997 : L’anarchie de commercialisation des DM continue
4-Septembre 2013 : adoption du Dahir n 1-13-90 du chaoual 11434 (30Aout 2013) portant promulgation de la loi n 24-12 relatif aux Dispositifs Médicaux
5- Septembre 2014, adoption du décret n° 2-14-607 22 du kaada 1435(18 septembre 2014) pris pour l'application de la loi n°84.12 relative aux dispositifs médicaux
6- Août 2015 : arrêté du ministre de la santé N° 2853-15 du 18 CHAOUAL 1436 (4 Août 2015) fixant le modèle de la déclaration des établissements de fabrication, d’importation, d’exportation, de distribution ou de maintenance de DM et le contenu du dossier de l’accompagnant.
7- Août 2015 : arrêté du ministre de la santé n ° 2854-15 du 18 CHAOUAL 1436 (4 Août 2015) fixant les modalités d’informations de l’administration de la délégation, au moyen de la sous traitance d’une ou plusieurs opérations de fabrication, d’exportation, de distribution ou de maintenance des D.M.
8- Août 2015 : arrêté du ministre de la santé n ° 2855-15 du 18 CHAOUAL 1436 (4 Août 2015) relatif à l’enregistrement et aux publicités des DM et fixant les conditions et la procédure d’octroi de l’autorisation spécifique pour les DM non soumis à l’obligation d’enregistrement.
9- Août 2015: arrêté du ministre de la santé N° 2856-15 du 18 CHAOUAL 1436 (4 AOÛT 2015) Fixant les règles de classification des dispositifs médicaux, les exigences essentielles de qualité, de sécurité et de performance des DM, les règles de bonne pratique de fabrication, de transport, de stockage, de distribution et d'évaluation de performance des DM et les modèles du rapport d'inspection, de du procès-verbal de constat des infractions.
On trouve de nombreuses dénominations de ces produits : parapharmacie, accessoires, fongibles, produits pharmaceutiques non médicamenteux, matériel médicochirurgical ou dispositifs médicaux.
Ces produits sont consommés en grande partie par le ministère de la santé (85%) (CHU, hôpitaux, dispensaires....). Pour le pharmacien d'officine, les produits pharmaceutiques non médicamenteux ne représentent qu’une partie de la pharmacopée (Article 5 de la loi 17/04).
D'une manière générale, les DM sont des produits :
- De plus en plus nombreux, (plus de 90 000 en Europe) (plus de 1,2million de références)
- Complexes, hétérogènes.
- Onéreux…. (budget, coût)
- Dont l'usage non dénué de risque, responsabilité…
Il faut connaître les DM pour :
- Bien les dispenser,
- Bien conseiller,
- En tirer le meilleur profit,
- Bien les défendre.
B- Exclusivité du pharmacien d’officine :
a-Les articles d'exclusivité du pharmacien dans la loi 17/04 et la loi 1-13-90 des DM :
Article 4 loi 17/04 : Définition
‘’On entend par produits pharmaceutiques non médicamenteux au sens de la présente loi :
- Les objets de pansement, produits et articles à usage médical figurant à la pharmacopée
- Les objets de pansement, produits et articles à usage médical, présentés sous une forme stérile conformément aux conditions de stérilité décrites dans la pharmacopée.’’
Article 29 loi 17/04 : Actes pharmaceutiques (la délivrance et les actes liés aux conseils)
‘’On entend par dispensation au sens de la présente loi, l’acte pharmaceutique qui consiste en :
- la délivrance d'un médicament ou d'un produit pharmaceutique non médicamenteux associée à l'analyse de l'ordonnance ou de la commande les concernant ;
- la mise à disposition du public des informations nécessaires au bon usage des médicaments et des produits pharmaceutiques ainsi que les actes liés aux conseils préventifs et à l'éducation pour la santé;…
Article 30 loi 17/04 : englobe toute l’exclusivité du pharmacien.
Sont réservées exclusivement aux pharmaciens d’officine :
- La préparation des médicaments visés aux 1, 2, et 3 de l'article 2 ci-dessus.
- La détention des produits ci-après en vue de leur dispensation au public :
Les médicaments ainsi que les objets de pansements, produits et articles définis à l'article 4 ci-dessus ;
Les laits ainsi que les aliments lactés diététiques pour nourrissons et les aliments de régime destinés aux enfants de premier âge.
A titre accessoire, les pharmaciens d'officine peuvent détenir et vendre :
- Toutes drogues, tous produits chimiques ou préparations pharmaceutiques, autres que ceux qui figurent à la (les) pharmacopée (s) en vigueur à condition qu'ils soient étiquetés et vendus conformément à leur composition ;
- Les produits destinés à l'entretien ou à l'application des lentilles de contact ;
- Les réactifs conditionnés en vue de la vente au public ;
- Les laits ainsi que les aliments lactés diététiques pour nourrissons et les aliments de régime destinés aux enfants de deuxième âge ;
- Les huiles essentielles ;
- les sucettes, les tétines et les biberons.
Article 112 loi 17/04 :
- Sous réserve des dérogations prévues par la présente loi, nul ne peut offrir, mettre en vente ou vendre au Public, en dehors d'une officine, des médicaments et produits pharmaceutiques non médicamenteux, notamment sur la voie, publique, sur les marchés, à domicile ou dans les magasins non affectés à la profession pharmaceutique.’’
b-Les articles d'exclusivité du pharmacien dans le Dahir n 1-13-90 :
- Article 7 du Dahir n 1-13-90 : Pour les officines de pharmacie, La dispensation des DM n’est pas soumise à la déclaration préalable, à condition d’acquérir des DM enregistrés conformément à la disposition de la présente loi ou autorisés pour ce qui est des dispositifs médicaux sur mesures ()
- Article 1 alinéa 11 du Dahir n 1-13-90 : Toute fois, la dispensation au public des produit des produits pharmaceutiques non médicamenteux visés à l’article 4 de la loi 17-04 portant code du médicament et de la pharmacie , considérés comme des dispositifs médicaux au sens de l’article 2 ci-dessous est réservée exclusivement aux pharmacien d’officine conformément à l’article 30 de ladite loi c'est à dire : les établissements (de fabrication, d'importation, d'exportation, de distribution ou de maintenance des dispositifs médicaux ) n'ont pas le droit de fabriquer, d’importer, d'exporter ou de distribuer les dispositifs médicaux exclusifs aux pharmaciens .
- Pour les officines de pharmacie (Article 7 du Dahir n 1-13-90) : La dispensation des DM n’est pas soumise à la déclaration préalable, à condition d’acquérir des DM enregistrés conformément à la disposition de la présente loi ou autorisés pour ce qui est des dispositifs médicaux sur mesures
- Les officines de pharmacie ont le droit de commercialiser tout dispositif médical.
2- DEFINITIONS :
Définition des Dispositifs Médicaux dans le Dahir n 1-13-90 :
Article premier du dahir :
- «On entend par dispositif médical (DM), à l’exception des produits d’origine humaine, tout matériel, article ou produit, utilisés à des fins médicales et dont l’action ne serait pas obtenue par un mécanisme pharmacologique, immunologique ou métabolique »
- Tout instrument, appareil, équipement, produit, à l’exception des produits d’origine humaine, ou autre article utilisé seul ou en association, y compris les accessoires et logiciels intervenant dans son fonctionnement, destiné par un fabricant à être utilisé chez l’homme à des fins :
A- à des fins de diagnostic, prévention, contrôle, traitement ou atténuation d’une Maladie.
Exemples :
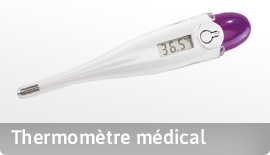
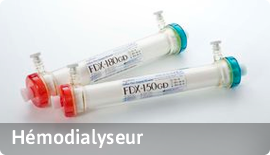
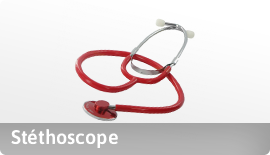
B- à des fins de diagnostic, contrôle, traitement ou atténuation ou compensation d’une blessure ou d’un handicap.
Exemples :




C- à des fins d’étude, de remplacement ou de modification de l’anatomie ou d’un processus Physiologique.
Exemples :

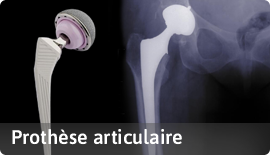


D- à des fins de maîtrise de la conception.
Exemples :
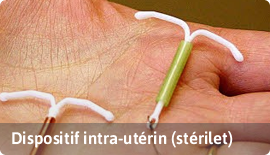
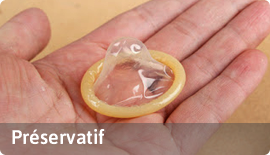

D'autres définitions des dispositifs cités dans le Dahir 1-13-90 :
A- Dispositifs invasifs : Dispositif qui pénètre partiellement ou entièrement à l’intérieur du corps soit par un orifice soit à travers la surface du corps.
Exemples :
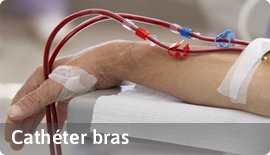
B- Dispositif invasif type chirurgical : dispositif qui pénètre à l’intérieur du corps à travers la surface du corps, à l’aide ou dans le cadre d’un acte chirurgical.
Exemples :

C- Dispositif implantable : ‘’Tout dispositif destiné à être implanté en totalité dans le corps humain ou à remplacer une surface épithéliale ou la surface de l’œil, grâce à une intervention chirurgicale et à demeurer en place après l’intervention’’.
Exemples :

D- Instrument chirurgical réutilisable : ‘’Instrument destiné à accomplir, sans être raccordé à un dispositif médical actif, un acte chirurgical tel que couper, forcer, racler, serrer, rétracter ou attacher et pouvant être réutilisé après avoir été soumis aux procédures appropriées.’’- Ciseaux, pinces à pansement, Écarteurs, Scalpels, lames, sondes, Instruments à suture, Pinces, Spéculum, dilatateurs, curettes.ect.
Exemples :
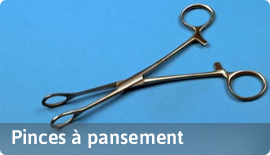


E- Dispositif médical actif : fonctionnement d’une source d’énergie électrique ou de toute source d’énergie autre que celle générée directement par le corps humain ou par la pesanteur agissant par conversion de cette énergie.’’
Exemple :

3- CLASSIFICATIONS DES DM :
Les DM sont classés en fonction de :
- Durée d’utilisation du DM : de quelques minutes à plusieurs années
- Du caractère Invasif ou non du dispositif
- Des fins d’utilisation du dispositif : Chirurgicales ou non
- Du caractère actif ou non
- De la partie vitale ou non du corps : système circulatoire, système nerveux central
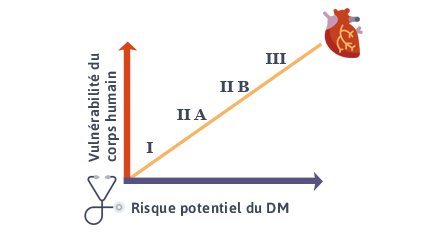
Nous avons donc 4 classes :
| Classe de risque I | Faible degré de risque |
| Classe de risque II A | Degré moyen de risque |
| Classe de risque II B | Potentiel Élevé de risque |
| lasse de risque III | Potentiel très sérieux de risque |
Classe I : DM non invasifs ou temporaires.
Exemples :


Exceptions de l’invasive (dans la Classe I)
Exemples :
- DM + peau lésée :

- DM temporaire, mais réutilisables :

- DM + orifices corporels :


- DM + orifices corporels :
Classe IIA :
- DM non invasifs et stériles destinés conduire ou stocker le sang, les liquides, tissus corporels ou les gaz ; et à être en contact avec une peau lésée.
- DM invasifs et stériles usage temporaire ou court terme.
Exemple


Classe IIB :
- DM invasifs et stériles long terme ; temporaire et chirurgical
- DM implantables sauf cœur ; circulation sang ; SNC.
Exemples :



Classe III :
- DM implantables cœur, circulation sang, SNC
- DM invasifs chirurgicaux : cœur ; SNC
- DM chirurgicaux fabriqués à partir de tissus d’origine animale ou incorporant une substance active.
Exemples :

4- REGLEMENTATIONS :
A- Introduction :
Règlementation en Europe :
3 grandes directives :
- Directive 93/42/CE : relative aux dispositifs médicaux (hors dispositifs médicaux implantables actifs) applicable depuis le 14 Juin 1998.
- Directive 90/385/CE : relative aux dispositifs implantables actifs.
- Directive 98/79/CE : relative aux dispositifs de diagnostic in vitro.
L’application de ces directives se traduit par l’apposition du marquage CE.
Règlementation Au Maroc :
- La loi 17/04 : notion de produits pharmaceutiques non médicamenteux, plus restrictive : monopole.
- Dahir n 1-13-90 du chaoual 11434(30Aout 2013) portant promulgation de la loi n 24-12 relatif aux Dispositifs Médicaux (Avant : La circulaire N°7 du 19 Février 1997 relative à l’enregistrement)
- Décret n° 2.14.607 d'application de la loi n°84.12 relative aux DM.
- Arrêté du ministre de la santé N° 2853-15 du 18 CHAOUAL 1436 (4 Août 2015) fixant le modèle de la déclaration des établissements de fabrication, d’importation, d’exportation, de distribution ou de maintenance de DM et le contenu du dossier de l’accompagnant.
- Arrêté du ministre de la santé n ° 2854-15 du 18 CHAOUAL 1436 (4 Août 2015) fixant les modalités d’informations de l’administration de la délégation, au moyen de la sous-traitance d’une ou plusieurs opérations de fabrication, d’exportation, de distribution ou de maintenance des D.M.
- Arrêté du ministre de la santé n ° 2855-15 du 18 CHAOUAL 1436 (4 Août 2015) relatif à l’enregistrement et aux publicités des DM et fixant les conditions et la procédure d’octroi de l’autorisation spécifique pour les DM non soumis à l’obligation d’enregistrement.
- arrêté du ministre de la santé N° 2856-15 du 18 CHAOUAL 1436 (4 AOÛT 2015) Fixant les règles de classification des dispositifs médicaux, les exigences essentielles de qualité, de sécurité et de performance des DM, les règles de bonne pratique de fabrication, de transport, de stockage, de distribution et d'évaluation de performance des DM et les modèles du rapport d'inspection, de du procès-verbal de constat des infractions
B- Les caractéristiques des règlementations des DM dans le Dahir n 1-13-90 :
1- Définitions et champs d’application du Dahir 1-13-90. Tout est bien défini dans cette loi :
- Définition des DM
- Définition de la fabrication des DM
- Définition des établissements de fabrication des DM
- Définition des établissements d’importation et d’exportation des DM
- Définition des établissements de distribution des DM (les officines sont pas tenues d’enregistrement des DM Article 7 du Dahir n 1-13-90) (Etablissements : Tout établissement appartenant à une personne physique ou morale)
- Pour les officines de pharmacie (Article 7 du Dahir n 1-13-90) : La dispensation des DM n’est pas soumise à la déclaration préalable, à condition d’acquérir des DM enregistrés conformément à la disposition de la présente loi ou autorisés pour ce qui est des dispositifs médicaux sur mesures
- Exclusivité pour le pharmacien d’officine dans le Dahir n 1-13-90 (voir plus haut).
2-Instauration d’une commission nationale consultative des dispositifs médicaux
Les caractéristiques de la commission :
- Les modalités et la composition de cette commission par voie réglementaire
- Révocation de tout membre de la commission en cas d’intérêt direct ou indirecte sur l’un des dossiers inscrit dans l’ordre du jour de la commission
Donne son avis sur :
- la demande d’enregistrement des DM
- La suspension ou le retrait de l’enregistrement
- Le retrait d’un DM du marché pour des raisons de santé publique
Composition de la commission :
- Cinq (5) membres représentants du ministère de ta santé, en l'occurrence le directeur du Médicament et de la Pharmacie dont il est le président,
- Cinq (5) professeurs de l'enseignement supérieur, exerçant dans les Centres hospitaliers universitaires, désignés par le ministre de la santé,
- Les directeurs des Centres hospitaliers universitaires (5 ou 6)
- L'inspecteur des services de santé des Forces Armées Royales
- Trois (3) membres représentants successivement le président du Conseil National de l'Ordre des Médecins, le président du Conseil National de l'Ordre des Médecins Dentistes et le président du Conseil National de l'Ordre des Pharmaciens
Par ailleurs, cette commission va élaborer un règlement intérieur qui doit être approuvé par le ministre de la santé.
3-Instauration de la matériovigilance : (fixées par voie réglementaire).
La matériovigilance a pour objet la surveillance des incidents ou des risques d'incidents résultant de l'utilisation des dispositifs médicaux postérieurement à leur mise sur le marché.
4-Traçabilité des DM: dans cette loi, les responsables des établissements de fabrication, d'importation, d'exportation et de distribution des dispositifs médicaux, les établissements de santé ainsi que les professionnels de santé sont tenus d'appliquer, dans la limite de leurs responsabilités respectives, les règles de traçabilité de certains dispositifs médicaux selon le degré de dangerosité ( Art 23).
5- Instauration de l'inspection :
Cette inspection est chargée de vérifier le respect des dispositions de cette loi et ses textes d’application (Modalités fixées par voie réglementaire)
NB : La liste des dispositifs médicaux ainsi que les règles de leur traçabilité sont fixées par voie réglementaire (Article 23)
C-Les mesures réglementaires du Décret n° 2.14.607 d'application de la loi n°84.12 relative aux DM :
- la déclaration des établissements de fabrication, d'importation, d’exportation, de distribution ou de maintenance des dispositifs médicaux ;
- la sous-traitance pour la réalisation des opérations de fabrication, d’exportation, de distribution ou de maintenance des dispositifs médicaux à un autre établissement ;
- l'enregistrement des dispositifs médicaux et son renouvellement ;
- la mise à jour du certificat d'enregistrement des dispositifs médicaux ;
- Les modalités de transfert du titulaire d’enregistrement ;
- l'âge, la liste, la classe et la nature des dispositifs médicaux usagés ou remis à neuf pouvant faire l'objet d'un enregistrement en vue de leur mise sur le marché ;
- les conditions et la procédure de délivrance des autorisations spécifiques ;
- les règles de classification et les exigences essentielles de qualité, de sécurité et de performance des dispositifs médicaux ;
- la liste des dispositifs médicaux concernés par l'obligation de maintenance ;
- les règles de bonnes pratiques de fabrication, de transport, de stockage, de distribution et d'évaluation de performance des dispositifs médicaux ;
- La liste et les règles de traçabilité de certains dispositifs médicaux ;
- Le contenu du dossier de demande du visa de publicité et la procédure d'octroi dudit visa ;
- l'organisation et les modalités de fonctionnement du système national de matériovigilance ;
- la composition et les modalités de fonctionnement de la commission nationale consultative des dispositifs médicaux ;
- les modalités d'inspection des établissements de fabrication, d'importation, d'exportation, de distribution et de maintenance des dispositifs médicaux.
5-TRAITEMENTS DES DM :
Les procédures de stérilisation des DM préconisés sont :
- Chaleur humide : «autoclave » 121°C / 15 min pour l'acier inoxydable (MMC), linge.
- Chaleur sèche : «étuve» 180°C /30 min pour les instruments chromés, verre.
Les procédures de conditionnement des DM préconisés sont :
1-Pour les DM stériles :
- Barrière infranchissable aux micro-organismes.
- Protection du DM contre les chocs et les agressions de l’environnement.
- Extraction et l’utilisation du DM dans des conditions aseptiques.
2-Pour l’emballage primaire «Protecteur Individuel de Stérilité » :
- Barrière imperméable aux micro-organismes qui sépare la zone intérieure stérile contenant le DM de la zone extérieure.
3-Pou l’emballage secondaire :
- Protection des DM stériles dans leur emballage primaire. L’emballage de transport.
6-ANNEXES (cliquez ici)
1-Dahir n 1-13-90 du chaoual 11434 (30Aout 2013) relatif aux Dispositifs Médicaux
2-CIRCULAIRE N° 7 du 19 février 1997 relatif aux Dispositifs Médicaux (abroger par le dahir n 1-13-90)
3-Décret n° 2.14.607 d'application de la loi n°84.12 relative aux DM
4-Arrêté du ministre de la santé N° 2853-15 du 18 CHAOUAL 1436 (4 Août 2015) fixant le modèle de la déclaration des établissements de fabrication, d’importation, d’exportation, de distribution ou de maintenance de DM et le contenu du dossier de l’accompagnant.
5-Arrêté du ministre de la santé n ° 2854-15 du 18 CHAOUAL 1436 (4 Août 2015) fixant les modalités d’informations de l’administration de la délégation, au moyen de la sous-traitance d’une ou plusieurs opérations de fabrication, d’exportation, de distribution ou de maintenance des D.M.
6-Arrêté du ministre de la santé n ° 2855-15 du 18 CHAOUAL 1436 (4 Août 2015) relatif à l’enregistrement et aux publicités des DM et fixant les conditions et la procédure d’octroi de l’autorisation spécifique pour les DM non soumis à l’obligation d’enregistrement.
7-Arrêté du ministre de la santé N° 2856-15 du 18 CHAOUAL 1436 (4 AOÛT 2015) Fixant les règles de classification des dispositifs médicaux, les exigences essentielles de qualité, de sécurité et de performance des DM, les règles de bonne pratique de fabrication, de transport, de stockage, de distribution et d'évaluation de performance des DM et les modèles du rapport d'inspection, de du procès-verbal de constat des infractions
8- Pharmacopée française 11éme édition
9-Directive européennes relative aux dispositifs médicaux : Directive 93/42/CE, Directive 90/385/CE, Directive 98/79/CE
10-Guide de bonnes pratiques de désinfection des dispositifs médicaux (Conseil Supérieur d'Hygiène Publique de France)
11-La classification française des dispositifs médicaux
12-Fichier classification et nomenclature des D.M (français)
13-Référentiels en pharmacie hospitalière (France)
14-Livret thérapeutique : Dispositifs médicaux implantables










